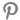
[시사투데이 이윤재 기자] 행정안전부와 식품의약품안전처는 의료제품의 허가·심사 전문성을 강화하고 신속한 제품화를 통한 국민들의 생명권 보장을 위해 의료제품 허가·심사 체계를 개편한다.
이번 의료제품 허가·심사 체계 개편으로 그동안 식품의약품안전평가원에서 수행하던 의료제품 허가업무는 식약처 본부 차장 직속과에서 수행하고 심사업무는 평가원에서 계속 수행하게 된다.
의료제품 허가 업무는 본부 차장 밑에 ‘허가총괄담당관’과 ‘첨단제품허가담당관’ 2개과를 신설해 운영한다. 평가원에서는 심사업무를 계속 수행하되 원장 밑에 ‘사전상담과’와 ‘신속심사과’ 2개과를 신설해 운영한다.
허가총괄담당관은 생약·한약제제를 포함한 의약품 허가, 의료제품 전반에 허가·심사 제도개선을 총괄한다. 첨단제품허가담당관은 의약외품을 포함해 융복합 의료제품과 바이오의약품, 의료기기 허가 업무를 담당한다.
사전상담과는 신속심사 대상인 의약품과 의료기기, 신약의 임상시험계획 승인신청, 품목허가 신청에 대한 사전상담 등을 수행한다. 신속심사과는 의약품과 의료기기 및 신약의 신속심사 지정신청에 자료 검토 등을 수행한다.
식약처 측은 “이번 허가·심사 체계개편으로 생명위협 질병치료제, 신종감염병 백신, 혁신신약 등에 대한 심사기간을 획기적으로 단축해 국민의 생명과 안전은 물론 제약업계의 글로벌 시장경쟁력 강화에도 노력하겠다“고 했다.
[저작권자ⓒ 시사투데이. 무단전재-재배포 금지]